- Фагоцит
-
 Микрофотография нейтрофила (из электронного микроскопа), фагоцитирующего Bacillus anthracis (оранжевая).
Микрофотография нейтрофила (из электронного микроскопа), фагоцитирующего Bacillus anthracis (оранжевая).
Фагоци́ты — клетки иммунной системы, которые защищают организм путём поглощения (фагоцитоза) вредных чужеродных частиц, бактерий, а также мёртвых или погибающих клеток[1]. Их название произошло от греческого phagein, «есть» или «поедать», и «-cyte», суффикс, в биологии означающий «клетка»[2]. Они важны для борьбы с инфекцией и постинфекционного иммунитета[3]. Фагоцитоз важен для всего животного мира[4] и высоко развит у позвоночных[5]. Фагоциты и фагоцитоз как способ пищеварения у животных были открыты И.И. Мечниковым при изучении губок и плоских червей. Роль фагоцитов в защите от бактерий была впервые открыта И.И.Мечниковым в 1882 году, когда он изучал личинок морских звёзд[6]. Мечников был удостоен в 1908 году Нобелевской премии по физиологии за создание клеточной теории иммунитета[7]. Фагоциты присутствуют в организмах многих видов; некоторые амёбы по многим деталям поведения похожи на макрофаги, что указывает на то, что фагоциты появились на ранних этапах эволюции.[8]
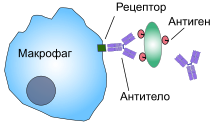
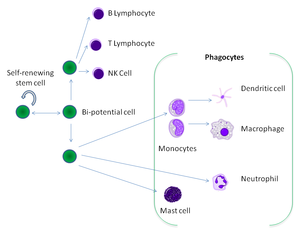
Фагоциты человека и других животных называют «профессиональными» или «непрофессиональными» в зависимости от того, насколько эффективно они фагоцитируют[9]. К профессиональным фагоцитам относятся нейтрофилы, моноциты, макрофаги, дендритные клетки и тучные клетки.[10] Основное отличие профессиональных фагоцитов от непрофессиональных в том, что профессиональные имеют молекулы, называемые рецепторы, на своей поверхности, которые обнаруживают чужеродные объекты, например бактерии.[11] Один литр крови взрослого человека в норме содержит около 2,5—7,5 млрд нейтрофилов, 200—900 млн моноцитов[12].
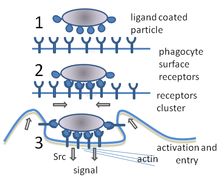
При инфекции химические сигналы привлекают фагоциты к месту, где патоген проник в организм. Эти сигналы могут исходить от бактерий или от других фагоцитов, уже присутствующих там. Фагоциты перемещаются путём хемотаксиса. Когда фагоциты контактируют с бактериями, рецепторы на их поверхности связываются с ними. Эта связь приводит к поглощению бактерий фагоцитами.[13] Некоторые фагоциты убивают проникших патогенов с помощью оксидантов и оксида азота.[14] После фагоцитоза, макрофаги и дендритные клетки могут также участвовать в презентации антигена — процессе, при котором фагоциты перемещают патогенный материал обратно на свою поверхность. Этот материал затем отображается (презентируется) для других клеток иммунной системы. Некоторые фагоциты поступают в лимфатические узлы и презентируют материал лимфоцитам. Этот процесс важен в формировании иммунитета.[15] Тем не менее, многие болезнетворные микроорганизмы устойчивы к атакам фагоцитов.[3]
История
Русский зоолог Илья Ильич Мечников (1845—1916) впервые определил, что специализированные клетки участвуют в защите от микробной инфекции. В 1882 году, он изучал подвижные клетки в личинках морских звёзд, полагая, что они важны для иммунной защиты животных. Чтобы проверить эту мысль, он воткнул небольшие иголки от мандаринового дерева в личинку. Через несколько часов он обнаружил, что подвижные клетки окружили иголки.[16] Мечников отправился в Вену и поделился своей идеей с Карлом Фридрихом Вильгельмом, который предложил название «фагоцит» для клеток, которые наблюдал Мечников.[17]
Год спустя, Мечников изучал пресноводное ракообразное — Дафнию, маленькое прозрачное животное, которое можно изучать непосредственно под микроскопом. Он обнаружил, что грибные споры, которые нападали на дафний, были уничтожены фагоцитами. Он перенёс свои наблюдения на белые кровяные клетки млекопитающих и обнаружил, что Bacillus anthracis может быть уничтожена фагоцитами. Этот процесс он назвал фагоцитоз.[18] Мечников предположил, что фагоциты — первичная защита от проникающих микроорганизмов.
В 1903 году, Алмрот Райт обнаружил, что фагоцитоз поддерживается специфическими антителами, которые он назвал опсонинами.[19] Мечников был награждён (вместе с Паулем Эрлихом) в 1908 году Нобелевская премия по физиологии или медицине за свою работу по фагоцитам и фагоцитозу.[7]
Хотя значение этих открытий постепенно получило признание в начале двадцатого века, сложные взаимоотношения между фагоцитами и другими компонентами иммунной системы, не были известны вплоть до 1980-х годов.[20]
Фагоцитоз
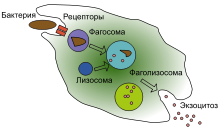
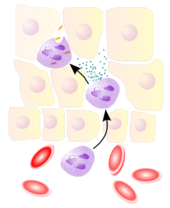
Фагоцитоз — процесс поглощения чужеродных частиц клетками.[21] Он включает последовательность молекулярных процессов.[22] Фагоцитоз возникает после связывания рецепторами чужеродного агента (например, бактерии). Затем фагоцит окружает бактерию и поглощает её. Фагоцитоз бактерии человеческим нейтрофилом происходит примерно за 9 минут.[23] Внутри фагоцита бактерия оказывается в составе фагосомы. В течение минуты фагосома сливается с лизосомой или гранулой, содержащими ферменты, с образованием фаголизосомы. Заключённая бактерия подвергается агрессивному воздействию[24] и погибает через несколько минут.[23] Дендритные клетки и макрофаги действуют не так быстро и фагоцитоз в этих клетках может протекать в течение многих часов. Макрофаги поглощают большое количество чужеродного материала и часто выделяют некоторые непереваренные частицы обратно. Этот материал является сигналом для миграции макрофагов из крови.[25] Фагоциты способны поглощать почти любое вещество.
Фагоциты имеют на своей поверхности множество различных рецепторов, благодаря которым они связывают чужеродный материал.[3] К ним относятся опсониновые рецепторы, скевенджер-рецепторы и Толл-подобные рецепторы. Опсониновые рецепторы усиливают фагоцитоз бактерий, которые покрыты иммуноглобулином G (IgG) или комплементом. «Комплемент» — комплекс белковых молекул в крови, которые разрушают клетки или помечают их для уничтожения.[26] Скевенджер-рецепторы крупными молекулами поверхности бактериальной клетки и Толл-подобные рецепторы связываются с более специфичными молекулами. Связывание Толл-подобных рецепторов усиливает фагоцитоз и вызывает выброс фагоцитами группы гормонов, которые вызывают воспаление.[3]
Механизмы уничтожения чужеродных агентов
Уничтожение микроорганизмов — важная функция фагоцитоза,[27] которая происходит либо при фагоцитозе (внутриклеточное уничтожение), либо вне фагоцита (внеклеточное уничтожение).
Внутриклеточный кислород-зависимый
Когда фагоцит поглощает бактерию (или любой другой чужеродный материал), увеличивается потребление кислорода, что называют респираторным взрывом. При этом образуются реактивные кислород-содержащие молекулы, которые обладают противомикробным действием.[28] Соединения кислорода токсичны как для патогена, так и для самой клетки, поэтому они хранятся в ячейках внутри самой клетки. Такой метод уничтожения проникающих микроорганизмов называют кислород-зависимое внутриклеточное уничтожение, который делится на 2 типа.[14]
Первый тип — кислород-зависимое образование супероксидного радикала[3], уничтожающего бактерии.[29] Супероксид превращается в пероксид водорода и синглетный кислород под действием фермента супероксиддисмутаза. Супероксиды также взаимодействуют с пероксидом водорода с образованием гидроксильной группы, которая помогает в уничтожении патогенных микробов.[3]
Ко второму типу относят использование фермента миелопероксидаза из нейтрофильных гранул.[30] Когда гранулы сливаются с фагосомой, миелопероксидаза освобождается в фаголизосому, и этот фермент использует пероксид водорода и хлор для создания гипохлорита. Гипохлорит крайне токсичен для бактерий.[3] Миелопероксидаза содержит пигмент гем, за счёт которого образуется зелёный цвет секретов, богатых нейтрофилами (например гной, инфицированная мокрота).[31]
Внутриклеточный кислород-независимый
Фагоциты также могут уничтожать микроорганизмы кислород-независимым методом, но он менее эффективен, чем кислород-зависимый. Различают 4 основных типа. При первом типе используются электрически заряженные белки, которые повреждают клеточную мембрану бактерий. При втором типе используются лизозимы; эти ферменты разрушают клеточную стенку бактерий. При третьем типе используются лактоферрины, которые присутствуют в гранулах нейтрофилов и удаляют необходимое железо из бактерий.[32] При четвёртом типе используются протеазы и гидролазы для переваривания белков разрушенных бактерий.[33]
Внеклеточные
Интерферон-гамма (который также называют фактор, активирующий макрофаги) активирует синтез макрофагами оксида азота. Источником интерферона-гамма могут быть CD4+ T лимфоциты, естественные киллеры, B-лимфоциты, T-киллеры, моноциты, макрофаги или дендритные клетки.[34] Оксид азота затем высвобождается из макрофагов и, в силу своей токсичности, уничтожает микробы вблизи макрофага.[3] Активированные макрофаги образуют и секретируют фактор некроза опухоли. Этот цитокин (класс сигнальной молекулы)[35] уничтожает раковые клетки и клетки, инфицированные вирусом, помогают активировать другие клетки иммунной системы.[36]
При некоторых заболеваниях, например, при редких хронических гранулёматозных заболеваниях, эффективность фагоцитоза нарушается, что может привести к возникновению бактериальных инфекций.[37] При таких заболеваниях существует аномалия в работе различных элементов кислород-зависимого уничтожения микробов. Другие редкие врождённые аномалии, например синдром Шедьяка–Штайнбринка–Хигаси, также связаны с дефектным уничтожением проникающих в организм микробов.[38]
Вирусы
Вирусы могут воспроизводиться только внутри клетки, и они проникают в неё, используя множество рецепторов, участвующих в иммунной защите. Попав внутрь клетки, вирусы используют её биологические процессы в свою пользу, заставляя клетку создавать тысячи вирусных частиц, подобных материнской. Хотя фагоциты и другие компоненты иммунной системы могут в ограниченной степени контролировать вирусы, когда вирус внутри клетки, приобретённый иммунитет (в частности лимфоциты) более важен для защиты.[39] В области вирусной инфекции лимфоцитов скапливается гораздо больше, чем остальных клеток иммунной системы; что наиболее типично для вирусного менингита.[40] Клетки, инфицированные вирусами, уничтожаются лимфоцитами и выводятся из организма фагоцитами.[41]
Роль в апоптозе
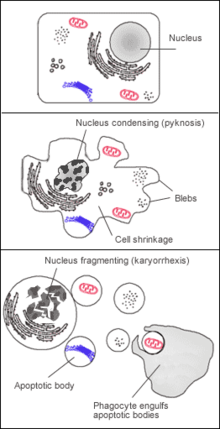
У животных, растений и грибов клетки постоянно погибают. Баланс между делением клетки и их гибелью сохраняет относительно постоянное число клеток у взрослых.[1] Существует 2 механизма гибели клетки: некроз или апоптоз. В отличие от некроза, который чаще возникает как результат заболевания или травмы, апоптоз (или запрограммированная гибель клеток) — нормальный процесс, протекающий в организме. Организм избавляет себя от миллионов мёртвых или погибающих клеток каждый день и фагоциты играют важную роль в этом процессе.[42]
Погибающая клетка, которая подвергается финальной стадии апоптоза,[43] обнажает молекулы, например фосфатидилсерин, на своей поверхности для соединения с фагоцитом.[44] Фосфатидилсерин обычно находится на цитозольной поверхности плазматической мембраны, но перемещается при апоптозе на внешнюю поверхность предположительно с помощью белка под названием скрамблаза.[45] Эти молекулы помечают клетку для фагоцитоза клетками, которые обладают соответствующими рецепторами, например макрофаги.[46] Удаление погибающих клеток фагоцитами происходит упорядоченным образом, не вызывая воспаления.[47]
Взаимодействие с другими клетками
Фагоциты движутся в организме, взаимодействуя с фагоцитарными и нефагоцитарными клетками иммунной системы. Они обмениваются информацией с другими клетками с помощью образования химических веществ, называемых цитокинами, которые вызывают другие фагоциты к области инфекции или активируют «спящие» лимфоциты.[48] Фагоциты составляют часть врождённого иммунитета, который появляется у животных, включая человека, при рождении. Врождённый иммунитет очень эффективен, но не специфичен в отношении определения разницы между видами патогенов. С другой стороны, приобретённый иммунитет более специализированный и может защищать почти от любого вида патогена.[49] Приобретённый иммунитет зависит от лимфоцитов, которые не фагоцитируют, но образуют защитные белки (антитела), которые помечают патогены для уничтожения и предупреждают инфицирование клеток вирусами.[50] Фагоциты, в частности дендритные клетки и макрофаги, стимулируют лимфоциты для образования антител при важном процессе, называемом презентация антигена.[51]
Презентация антигена
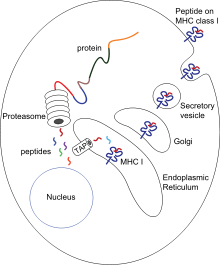
Презентация антигена — процесс, при котором некоторые фагоциты перемещают части поглощённого материала назад на свою поверхность и «предоставляют» их для других клеток иммунной системы.[52] Существуют 2 вида «профессиональных» антиген-презентирующих клеток: макрофаги и дендритные клетки.[53] После поглощения, чужеродные белки (антигены) разрушаются до пептидов внутри дендритной клетки или макрофага. Эти пептиды затем связываются с гликопротеинами главного комплекса гистосовместимости (MHC) клетки, которые осуществляют возвращение назад на поверхность фагоциты, где они могут быть «представлены» лимфоцитам.[15] Старые макрофаги не способны быстро перемещаться из области инфицирования, но дендритные клетки могут достигать лимфатических узлов организма, где находятся миллионы лимфоцитов.[54] Это улучшает иммунитет, потому что лимфоциты реагируют на антигены, презентированные дендритными клетками, так же, как если бы они находились в первичной области инфекции.[55] Но дендритные клетки также способны разрушать или подавлять активность лимфоцитов, если они распознают компоненты тела хозяина; это важно для предупреждения аутоиммунных реакций. Этот процесс называют толерантностью.[56]
Иммунологическая толерантность
Дендритные клетки также способствуют иммунологической толерантности,[57], при которой предупреждается иммунологическая атака организма самого себя. Первый тип толерантности — центральная толерантность: когда созревшие T-лимфоциты впервые выходят из тимуса, дендритные клетки разрушают дефектные Т-лимфоциты, которые несут антигены, что может вызывать аутоиммунную реакцию. Второй тип иммунологической толерантности — периферическая толерантность. Некоторые Т-лимфоциты, которые обладают антигенным свойством, способны пройти первый тип толерантности, некоторые Т-лимфоциты развивают аутоиммунные антигены позднее в жизни, и некоторые аутоиммунные антигены не обнаруживаются в тимусе; поэтому дендритные клетки будут работать, опять же, для сдерживания активности аутоиммунных Т-лимфоцитов вне тимуса. Дендритные клетки могут сделать это путём разрушения их или с помощью привлечения Т-супрессоров для дезактивации вредоносных Т-лимфоцитов.[58] Когда иммунологическая толерантность не срабатывает, могут возникнуть аутоиммунные заболевания.[59] С другой стороны, повышенная толерантность может привести к возникновению инфекций, например ВИЧ-инфекции.[58]
Профессиональные фагоциты
Фагоциты человека и других позвоночных разделяют на «профессиональные» и «непрофессиональные» группы на основе эффективности, при которой они участвуют в фагоцитозе.[9] К профессиональным фагоцитам относят моноциты, макрофаги, нейтрофилы, тканевые дендритические клетки и тучные клетки.[10]
Активация
Все фагоциты, особенно макрофаги, находятся в состоянии готовности. Макрофаги, как правило, относительно пассивны в тканях и размножаются медленно. В таком состоянии полу-покоя они очищают организм от мёртвых клеток и другого неинфекционного мусора и редко принимают участие в презентации антигена. Но при возникновении инфекции они получают химические сигналы (обычно интерферон гамма), которые увеличивают продукцию ими MHC II молекул и подготавливают их к презентации антигена. В таком состоянии, макрофаги — хорошие антиген-презентаторы и киллеры. Однако, если они получают сигнал прямо от патогена, они становятся «гиперактивными», прекращают размножение и концентрируются на уничтожении. Их размер и скорость фагоцитоза увеличивается; некоторые становятся достаточно крупными, чтобы поглотить проникающих в организм простейших.[60]
В крови нейтрофилы неактивны, но движутся по ней с большой скоростью. Когда они получают сигналы от макрофагов из зоны воспаления, они замедляются и выходят из крови. В тканях они активируются цитокинами и поступают в зону действия готовыми уничтожать.[61]
Миграция
Когда происходит инфекционное заражение, химический «SOS» сигнал выделяется для привлечения фагоцитов в зону инфекции.[62] Эти химические сигналы могут включать белки от поступающих бактерий, системы свёртывания пептидов, продукты системы комплемента, а также цитокины, которые выделяются макрофагами, расположенными в ткани в области инфекции.[3] Другая группа химических аттрактантов — цитокины, которые вызывают нейтрофилы и моноциты из кровеносного русла.[13]
Для достижения зоны инфекции, фагоциты выходят из кровеносного русла и проникают в поражённую ткань. Сигналы от инфекции вызывают синтез эндотелиальными клетками, выстилающие кровеносный сосуд, белка, называемого селектин, который сцепляется с проходящими нейтрофилами. Вазодилататоры ослабляют соединительные связи эндотелиальных клеток, что позволяет фагоцитами проходить через стенку сосуда. Хемотаксис — процесс, при котором фагоциты следуют на «запах» цитокинов к области инфекции.[3] Нейтрофилы проникают через органы, покрытые эпителиальной тканью, в зону инфекции, и хотя это важный компонент борьбы с инфекцией, миграция сама по себе может привести к возникновению симптомов заболевания.[63] При инфекции миллионы нейтрофилов вызываются из крови, но они погибают затем в течение нескольких дней.[64]
Моноциты
Моноциты развиваются в костном мозге и достигают зрелости в крови. Зрелые моноциты имеют крупное, гладкое, дольчатое ядро и цитоплазму, которая содержит гранулы. Моноциты поглощают чужеродные или опасные вещества и презентируют антигены другим клеткам иммунной системы. Моноциты образуют 2 группы: циркулирующая и краевая, которые остаются в других тканях (около 70 % находятся в краевой группе). Большинство моноцитов покидают кровеносное русло через 20-40 часов, попадая в ткани и органы, где они превращаются в макрофаги[65] или дендритические клетки в зависимости от получаемого сигнала.[66] В 1 литре крови человека находится около 500 миллионов моноцитов.[12]
Макрофаги
Зрелые макрофаги не перемещаются быстро, но стоят на страже в тех областях организма, которые подвержены воздействию внешней среды. Там они действуют как сборщики мусора, антиген представляющие клетки или агрессивные киллеры в зависимости от получаемого сигнала.[67] Они образуются из моноцитов, гранулоцитов стволовых клеток или при клеточном делении уже существующих макрофагов.[68] Макрофаги человека диаметром около 21 микрометра.[69]
Этот вид фагоцитов не имеет гранул, но содержит много лизосом. Макрофаги находятся по всему телу почти во всех тканях и органах (например, клетки микроглии в головном мозге и альвеолярные макрофаги в лёгких). Расположение макрофага можно определить по его размеру и внешнему виду. Макрофаги вызывают воспаление путём образования интерлейкина 1, интерлейкина 6 и фактора некроза опухоли.[70] Макрофаги обычно находятся только в тканях и редко попадают в кровоток. Продолжительность жизни тканевых макрофагов, по разным оценкам, от 4 до 5 дней.[71]
Макрофаги могут быть активированы для выполнения функций, которые покоящийся моноцит не может.[70] Т-хелперы подгруппа лимфоцитов, отвечающих за активацию макрофагов. Они активируют макрофаги, посылая сигнал в виде интерферона гамма и экспрессируя белок CD154.[72] Другие сигналы поступают от бактерий в виде фактора некроза опухоли альфа и липополисахаридов.[70] Т-хелперы способны привлекать другие фагоциты в зону инфекции несколькими путями. Они выделяют цитокины, которые действуют на костный мозг, стимулируя образование моноцитов и нейтрофилов и они выделяют некоторые цитокины, которые отвечают за миграцию моноцитов и нейтрофилов в кровеносное русло.[73] Т-хелперы появляются при дифференцировке CD4+ Т лимфоцитов, когда они реагируют на действие антигена в периферических лимфатических тканях.[70] Активированные макрофаги играют важную роль в разрушении опухолей путём образования фактора некроза опухоли альфа, гамма-интерферона, оксида азота, реактивных форм кислорода, катионных белков и гидролитических ферментов.[70]
Нейтрофилы
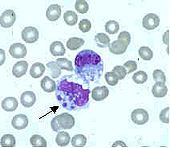
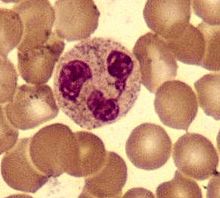 Сегментоядерный нейтрофил (в центре) в окружении эритроцитов, в цитоплазме видны внутриклеточные гранулы (микрофотография, окраска по Романовскому — Гимзе)
Сегментоядерный нейтрофил (в центре) в окружении эритроцитов, в цитоплазме видны внутриклеточные гранулы (микрофотография, окраска по Романовскому — Гимзе)
Нейтрофилы обычно находятся в кровеносном русле и являются наиболее распространённым типом фагоцитов, составляя 50-60 % от всех циркулирующих в крови белых кровяных клеток.[74] Один литр крови взрослого человека в норме содержит около 2,5—7,5 миллиардов нейтрофилов.[12] Их диаметр около 10 микрометров[75] и живут только в течение 5 дней.[36] Как только поступает соответствующий сигнал, они в течение примерно 30 минут выходят из крови и достигают зоны инфекции.[76] Они способны быстро поглощать чужеродный материал. Нейтрофилы не возвращаются в кровь; они превращаются в клетки гноя и погибают.[76] Зрелые нейтрофилы меньше, чем моноциты, и имеют сегментированные ядра с несколькими секциями; каждая секция соединяется с хроматиновыми нитями (нейтрофил может иметь 2-5 сегмента). Обычно нейтрофилы не выходят из костного мозга до наступления зрелости, но при инфекции высвобождаются в кровь предшественники нейтрофилов — миелоциты и промиелоциты.[77]
Внутриклеточные гранулы нейтрофилов человека разрушают белки и обладают бактерицидными свойствами.[78] Нейтрофилы способны выделять продукты, которые стимулируют моноциты и макрофаги. Нейтрофильные выделения усиливают фагоцитоз и образование реактивных форм кислорода, участвуя таким образом во внутриклеточном уничтожении.[79] Выделения от первичных гранул нейтрофилов стимулируют фагоциоз бактерий, покрытых IgG.[80]
Дендритные клетки
Дендритные клетки — специализированные антиген-презентирующие клетки, у которых есть длинные отростки, называемые дендритами,[81] которые помогают поглощать микробы и другие патогены.[82][83] Дендритные клетки находятся в тканях, которые контактируют с окружающей средой, в основном в коже, внутренней оболочке носа, лёгких, желудка и кишечника.[84] После активации, они созревают и мигрируют в лимфатические ткани, где взаимодействуют с Т- и B-лимфоцитами для возникновения и организации приобретённого иммунного ответа.[85] Зрелые дендритные клетки активируют Т-хелперы и Т-киллеры.[86] Активированные Т-хелперы взаимодействуют с макрофагами и B-лимфоцитами чтобы активировать их, в свою очередь. Кроме того, дендритные клетки способны влиять на возникновение того или иного типа иммунного ответа; когда они перемещаются в лимфатические зоны, они способны активировать находящиеся там Т-лимфоциты, которые затем дифференцируют в Т-киллеры и Т-хелперы.[87]
Тучные клетки
Тучные клетки имеют Толл-подобные рецепторы и взаимодействуют с дендритными клетками, Т- и B-лимфоцитами. Тучные клетки выделяют MHC молекулы класса II и могут принимать участие в презентации антигена; однако, роль тучных клеток в презентации антигена ещё не достаточно изучена.[88] Тучные клетки способны поглощать, убивать грамотрицательные бактерии (например, сальмонелла) и обрабатывать их антигены.[89] Они специализируются на обработке фимбриальных белков на поверхности бактерий, которые участвуют в прикреплении к тканям.[90][91] Кроме этих функций, тучные клетки образуют цитокины, которые запускают реакцию воспаления.[92] Это важная часть уничтожения микробов, потому что цитокины привлекают больше фагоцитов к зоне инфекции.[89]
Профессиональные фагоциты[93] Основное расположение Варианты фенотипов Кровь нейтрофилы, моноциты Костный мозг макрофаги, моноциты, синусоидные клетки, обкладочные клетки Костная ткань Остеокласты Кишечник и кишечные бляшки Пейера макрофаги Соединительная ткань Гистиоциты, макрофаги, моноциты, дендритные клетки Печень клетки Купфера, моноциты Лёгкое самовоспроизводящиеся макрофаги, моноциты, тучные клетки, дендритные клетки Лимфатическая ткань свободные и фиксированные и моноциты, дендритные клетки Нервная ткань Клетки микроглии (CD4+) Селезёнка свободные и фиксированные макрофаги, моноциты, синусоидные клетки Тимус свободные и фиксированные макрофаги и моноциты Кожа постоянные клетки Лангерханса, другие дендритные клетки, макрофаги, тучные клетки Непрофессиональные фагоциты
Умирающие клетки и чужеродные организмы поглощаются клетками, отличными от «профессиональных» фагоцитов.[94] К таким клеткам относят эпителиальные, эндотелиальные, паренхиматозные клетки и фибробласты. Их называют непрофессиональными фагоцитами, чтобы подчеркнуть, что в отличие от профессиональных фагоцитов, фагоцитоз для них не основная функция.[95] Фибробласты, например, которые могут фагоцитировать коллаген в процессе ремоделирования шрамов, также способны частично поглощать чужеродные частицы.[96]
Непрофессиональные фагоциты более ограничены, чем профессиональные, в отношении частиц, которые они могут поглотить. Это связано с отсутствием у них эффективных фагоцитарных рецепторов, в частности опсонинов.[11] Кроме того, большинство непрофессиональных фагоцитов не образуют реактивные кислород-содержащие молекулы для фагоцитоза.[97]
Непрофессиональные фагоциты[93] Основное расположение Варианты фенотипов Кровь, лимфа и лимфатические узлы Лимфоциты Кровь, лимфа и лимфатические узлы Естественные киллеры и крупные гранулярные лимфоциты Кожа Эпителиоциты Кровеносные сосуды Эндотелиоциты Соединительная ткань Фибробласты Кровь Эритроциты Устойчивость патогена
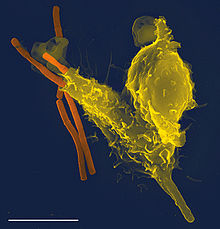
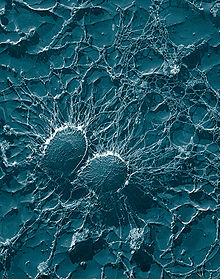 Клетки бактерии Staphylococcus aureus: крупные, волокнистые капсулы, защищающие от атаки фагоцитов.
Клетки бактерии Staphylococcus aureus: крупные, волокнистые капсулы, защищающие от атаки фагоцитов.
Патоген вызывает инфекцию, если только он преодолел защиту макроорганизма. Патогенные бактерии и простейшие развивают различные механизмы устойчивости к атакам фагоцитов, и многие из них действительно выживают и размножаются внутри фагоцитирующих клеток.[98][99]
Избежание контакта
У бактерий есть несколько способов избежать контакта с фагоцитами. Во-первых, они могут расти в местах, куда фагоциты не способны попасть (например, повреждённый кожный покров). Во-вторых, бактерия может подавлять реакцию воспаления; без этой реакции фагоциты не способны реагировать на инфекцию адекватно. В-третьих, некоторые виды бактерий могут замедлять способность фагоцитов перемещаться в зону инфекции, препятствуя хемотаксису.[98] В-четвёртых, некоторые бактерии способны избегать контакта с фагоцитом путём обмана иммунной системы, которая начинает «думать», что бактерия — клетка самого макроорганизма. Бледная трепонема (бактерия, вызывающая сифилис) скрывается от фагоцитов, покрывая свою поверхность фибронектином,[100] который естественно образуется в макроорганизме и играет важную роль в заживлении раны.[101]
Избежание поглощения
Бактерии часто образуют белки или сахара, которые покрывают их клетки и препятствуют фагоцитозу; они входят в состав бактериальной капсулы.[98] Например, K5 капсула и O75 O антиген присутствуют на поверхности Escherichia coli,[102] и экзополисахаридные капсулы Staphylococcus epidermidis.[103] Пневмококк образует несколько типов капсул, которые обеспечивают различные уровни защиты,[104] и стрептококки группы А образуют белки, например M белок и фимбриальные белки, которые блокируют процесс поглощения. Некоторые белки препятствуют опсонин-связанному поглощению; Staphylococcus aureus образует белок А для блокирования рецепторов антител, что снижает эффективность опсонинов.[105]
Выживание внутри фагоцита
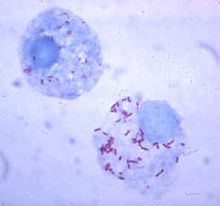 Риккетсия (красным цветом), которая живёт в цитоплазме непрофессионального фагоцита.
Риккетсия (красным цветом), которая живёт в цитоплазме непрофессионального фагоцита.
У бактерий развиты способы выживания внутри фагоцитов, где они продолжают уклоняться от иммунной системы.[106] Для безопасного проникновения внутрь фагоцита они выделяют белки, называемые «инвазинами». Оказавшись внутри клетки, они остаются в цитоплазме и избегают воздействия токсических веществ, содержащихся в фаголизосомах.[107] Некоторые бактерии препятствуют слиянию фагосомы и лизосомы.[98] Другие патогены, например лейшмании, образуют высокомодифицированные вакуоли внутри фагоцитов, что позволяет им сохранять устойчивость и размножаться.[108] Legionella pneumophila образует секрет, который заставляет фагоциты сливаться с везикулами, отличными от тех, что содержат токсичные вещества.[109] Другие бактерии способны жить внутри фаголизосом. Staphylococcus aureus, например, образует ферменты каталаза и супероксиддисмутаза, которые разрушают химические вещества (например, пероксид водорода), образуемые фагоцитами для уничтожения бактерий.[110] Бактерии могут выходить из фагосомы перед образованием фаголизосомы: Listeria monocytogenes способна образовывать отверстие в стенке фагосомы, используя ферменты, называемые листериолизин O и фосфолипаза C.[111]
Уничтожение
У бактерий развиты некоторые способы уничтожения фагоцитов.[105] К ним относятся цитолизины, которые образуют поры в клеточной мембране фагоцитов, стрептолизины и лейкоцидины, которые вызывают разрыв гранул нейтрофилов освобождение токсических веществ,[112][113] и экзотоксины, которые снижают поступления АТФ для фагоцитов, необходимых для фагоцитоза. Будучи поглощёнными, бактерии могут убивать фагоциты, высвобождая токсины, которые перемещаются из мембран фагосом или фаголизосом к другим частям клетки.[98]
Нарушение передачи сигнала в клетке
Множество мелких клеток лейшмании внутри более курпных клеток
Некоторые стратегии выживания часто связаны с нарушением цитокиновой и других методов передачи сигнала в клетке для предотвращения реакции фагоцитов на инвазию.[114] Такие паразитические простейшие как например Toxoplasma gondii, Trypanosoma cruzi и Leishmania инфицируют макрофаги; каждый из них имеет уникальный способ подавления активности макрофагов. Некоторые виды лейшманий изменяют систему сигналов инфицированных макрофагов, подавляют продукцию цитокинов и микробоцидных молекул (оксида азота, реактивных форм кислорода) и нарушают презентацию антигена.[115]
Повреждение макроорганизма фагоцитами
Макрофаги и нейтрофилы, в частности, играют центральную роль в воспалительном процессе путём высвобождения белков и низкомолекулярных воспалительных медиаторов, которые контролируют инфекцию, но могут повреждать ткани макроорганизма. В общем, цель фагоцитов — разрушение патогенов путём поглощения их и последующего воздействия на них токсичными веществами внутри фаголизосом. Если фагоцит не в состоянии поглотить свою цель, эти токсические агенты могут быть выделены в окружающую среду (действие называется «фрустрированный фагоцитоз»). Так как эти агенты токсичны и для клеток макроорганизма, они могут вызвать значительное повреждение здоровых клеток и тканей.[116]
Если нейтрофилы освобождают содержимое гранул (реактивные формы кислорода и протеазы) в почках, то происходит деградация внеклеточного матрикса макроорганизма, что может привести к повреждению клубочковых клеток, влияя на их способность фильтровать кровь и вызывая изменения в их форме. Кроме этого, продукты фосфолипазы (например, лейкотриены) усиливают повреждение. Это освобождение веществ способствует хемотаксису большего количества нейтрофилов в зону инфекции и клубочковые клетки могут быть повреждены ещё сильнее путём прикрепления молекул при миграции нейтрофилов. Повреждения клубочковых клеток может привести к почечной недостаточности.[117]
Нейтрофилы также играют ключевую роль в развитии большинства форм острого повреждения лёгких.[118] При этом активированные нейтрофилы высвобождают содержимое своих токсичных гранул в окружающую среду лёгких.[119] Эксперименты показали, что уменьшение числа нейтрофилов снижают эффекты острого повреждения лёгких,[120] но лечение подавлением нейтрофилов клинически не реалистично, так как при этом организм становится уязвим для инфекций.[119] В печени, повреждение нейтрофилами может способствовать дисфункции и повреждению в ответ на освобождение эндотоксина, выделяемого бактерией, сепсис, травму, алкогольный гепатит, ишемию и гиповолемический шок в результате острой кровопотери.[121]
Химические вещества, высвобождаемые макрофагами, могут также повреждать ткани макроорганизма. Фактор некроза опухоли-α (ФНО) — важное химические вещество, выделяемое макрофагами, которое приводит к свёртыванию крови в мелких сосудах, что предотвращает распространение инфекции.[122] Однако, если бактериальная инфекция проникает в кровь, ФНО-α выделяется в жизненно-важных органах, где может вызвать вазодилатацию и уменьшить объём плазмы; это в свою очередь может привести к септическому шоку. При септическом шоке, высвобождение ФНО-α вызывает блокаду мелких сосудов, которые кровоснабжают жизненноважные органы и может возникнуть их недостаточность. Септический шок может привести к смерти.[13]
Эволюционное происхождение
Фагоцитоз, вероятно, появился на ранних этапах эволюции ,[123] впервые возникнув у одноклеточных эукариот.[124] Амёбы — одноклеточные простейшие, которые отделились от дерева, ведущего к многоклеточным, но они передали множество специфических функций фагоцитарным клеткам млекопитающих.[124] Амёба Dictyostelium discoideum, например, живёт в почве и питается бактериями. Как и фагоциты животных, они поглощают бактерии путём фагоцитоза в основном с помощью Толл-подобных рецепторов и имеют другие биологические функции, общие с макрофагами.[125] Амёбы Dictyostelium discoideum социальны; они слипаются вместе, когда голодают, превращаясь в мигрирующую псевдоплазмодию или личинку. Такой многоклеточный организм в итоге образует плодовое тело со спорами, которое устойчиво к агрессии окружающей среды. Перед образованием плодовых тел, клетки могут перемещаться как личинкоподобные организмы в течение нескольких дней. В течение этого времени воздействие токсинов или бактериальных патогенов может представлять опасность для выживания амёб, ограничивая образование спор. Некоторые амёбы поглощают бактерии и абсорбируют их токсины. В конечном итоге эти амёбы погибают. Они генетически схожи с другими амёбами в личинке и жертвуют собой для защиты других амёб от бактерий, что схоже с самопожертвованием фагоцитов иммунной системы человека. Такая врождённая иммунная функция у социальных амёб предполагает, что древний механизм поглощения клеток мог быть приспособлен для защитной функция задолго до появления разнообразных животных.[126] Но общее происхождение с фагоцитами млекопитающих не доказано. Фагоциты присутствуют во всём животном царстве,[4] начиная от морской губки и заканчивая насекомыми, низшими и высшими позвоночными.[127][128] Способность амёб различать своих и чужих стала основой иммунной системы многих видов.[8]
См. также
Примечания
- ↑ 1 2 Thompson, CB (1995). «Apoptosis in the pathogenesis and treatment of disease». Science 267 (5203): 1456–62. DOI:10.1126/science.7878464. PMID 7878464.
- ↑ The Shorter Oxford English Dictionary. — Oxford University Press (Guild Publishing). — P. 1566–67.
- ↑ 1 2 3 4 5 6 7 8 9 10 Mayer, Gene Immunology — Chapter One: Innate (non-specific) Immunity. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Архивировано из первоисточника 23 августа 2011. Проверено 12 ноября 2008.
- ↑ 1 2 Delves et al. 2006, p. 250
- ↑ Delves et al. 2006, p. 251
- ↑ Ilya Mechnikov, retrieved on November 28, 2008. From Nobel Lectures, Physiology or Medicine 1901—1921, Elsevier Publishing Company, Amsterdam, 1967. Архивная копия от 22 августа 2008 на Wayback Machine
- ↑ 1 2 Schmalstieg, FC; AS Goldman (2008). «Ilya Ilich Metchnikoff (1845–1915) and Paul Ehrlich (1854–1915): the centennial of the 1908 Nobel Prize in Physiology or Medicine». Journal of medical biography 16 (2): 96–103. DOI:10.1258/jmb.2008.008006. PMID 18463079.
- ↑ 1 2 Janeway, Chapter: Evolution of the innate immune system. see Bibliography, retrieved on March 20, 2009
- ↑ 1 2 Ernst & Stendahl 2006, p. 186
- ↑ 1 2 Robinson & Babcock 1998, p. 187 and Ernst & Stendahl 2006, pp. 7–10
- ↑ 1 2 Ernst & Stendahl 2006, p. 10
- ↑ 1 2 3 Hoffbrand, Pettit & Moss 2005, p. 331
- ↑ 1 2 3 Janeway, Chapter: Induced innate responses to infection. see Bibliography, retrieved on March 20, 2009
- ↑ 1 2 Fang FC (October 2004). «Antimicrobial reactive oxygen and nitrogen species: concepts and controversies». Nat. Rev. Microbiol. 2 (10): 820–32. DOI:10.1038/nrmicro1004. PMID 15378046.
- ↑ 1 2 Janeway, Chapter: Antigen Presentation to T Lymphocytes. see Bibliography, retrieved on March 20, 2009
- ↑ Delves et al. 2006, p. 3
- ↑ Aterman K (1 April 1998). «Medals, memoirs—and Metchnikoff». J. Leukoc. Biol. 63 (4): 515–17. PMID 9544583.
- ↑ Ilya Mechnikov. The Nobel Foundation. Архивировано из первоисточника 10 февраля 2012. Проверено 28 ноября 2008.
- ↑ Delves et al. 2006, p. 263
- ↑ Robinson & Babcock 1998, p. vii
- ↑ Ernst & Stendahl 2006, p. 4
- ↑ Ernst & Stendahl 2006, p. 78
- ↑ 1 2 Hampton MB, Vissers MC, Winterbourn CC (February 1994). «A single assay for measuring the rates of phagocytosis and bacterial killing by neutrophils». J. Leukoc. Biol. 55 (2): 147–52. PMID 8301210.
- ↑ Delves et al. 2006, pp. 6–7
- ↑ Sompayrac 2008, p. 3
- ↑ Sompayrac 2008, pp. 13–16
- ↑ Dale DC, Boxer L, Liles WC (August 2008). «The phagocytes: neutrophils and monocytes». Blood 112 (4): 935–45. DOI:10.1182/blood-2007-12-077917. PMID 18684880.
- ↑ Dahlgren, C; A Karlsson (December 17, 1999). «Respiratory burst in human neutrophils.». Journal of Immunological Methods 232 (1–2): 3–14. DOI:10.1016/S0022-1759(99)00146-5. PMID 10618505.
- ↑ Shatwell, KP; AW Segal (1996). «NADPH oxidase.». The international journal of biochemistry and cell biology. 28 (11): 1191–95. DOI:10.1016/S1357-2725(96)00084-2. PMID 9022278.
- ↑ Klebanoff SJ (1999). «Myeloperoxidase». Proc. Assoc. Am. Physicians 111 (5): 383–89. PMID 10519157.
- ↑ Meyer KC (September 2004). «Neutrophils, myeloperoxidase, and bronchiectasis in cystic fibrosis: green is not good». J. Lab. Clin. Med. 144 (3): 124–26. DOI:10.1016/j.lab.2004.05.014. PMID 15478278.
- ↑ Hoffbrand, Pettit & Moss 2005, p. 118
- ↑ Delves et al. 2006, pp. 6–10
- ↑ Schroder K, Hertzog PJ, Ravasi T, Hume DA (February 2004). «Interferon-gamma: an overview of signals, mechanisms and functions». J. Leukoc. Biol. 75 (2): 163–89. DOI:10.1189/jlb.0603252. PMID 14525967.
- ↑ Delves et al. 2006, p. 188
- ↑ 1 2 Sompayrac 2008, p. 17
- ↑ Lipu HN, Ahmed TA, Ali S, Ahmed D, Waqar MA (September 2008). «Chronic granulomatous disease». J Pak Med Assoc 58 (9): 516–18. PMID 18846805. Проверено February 20, 2009.
- ↑ Kaplan J, De Domenico I, Ward DM (January 2008). «Chediak-Higashi syndrome». Curr. Opin. Hematol. 15 (1): 22–29. DOI:10.1097/MOH.0b013e3282f2bcce. PMID 18043242. Проверено April 11, 2009.
- ↑ Sompayrac 2008, p. 7
- ↑ de Almeida SM, Nogueira MB, Raboni SM, Vidal LR (October 2007). «Laboratorial diagnosis of lymphocytic meningitis». Braz J Infect Dis 11 (5): 489–95. PMID 17962876. Проверено March 29, 2009.
- ↑ Sompayrac 2008, p. 22
- ↑ Sompayrac 2008, p. 63
- ↑ Apoptosis. Merriam-Webster Online Dictionary. Архивировано из первоисточника 10 февраля 2012. Проверено 19 марта 2009.
- ↑ Li MO, Sarkisian MR, Mehal WZ, Rakic P, Flavell RA (November 2003). «Phosphatidylserine receptor is required for clearance of apoptotic cells». Science (journal) 302 (5650): 1560–63. DOI:10.1126/science.1087621. PMID 14645847. (Free registration required for online access)
- ↑ Wang X, et al. (2003). «Cell corpse engulfment mediated by C. elegans phosphatidylserine receptor through CED-5 and CED-12». Science 302 (5650): 1563–1566. DOI:10.1126/science.1087641. PMID 14645848. (Free registration required for online access)
- ↑ Savill J, Gregory C, Haslett C. (2003). «Eat me or die». Science 302 (5650): 1516–17. DOI:10.1126/science.1092533. PMID 14645835.
- ↑ Zhou Z, Yu X (October 2008). «Phagosome maturation during the removal of apoptotic cells: receptors lead the way». Trends Cell Biol. 18 (10): 474–85. DOI:10.1016/j.tcb.2008.08.002. PMID 18774293.
- ↑ Sompayrac 2008, p. 44
- ↑ Sompayrac 2008, p. 4
- ↑ Sompayrac 2008, pp. 24–35
- ↑ Delves et al. 2006, pp. 171–184
- ↑ Delves et al. 2006, pp. 456
- ↑ Timothy Lee Antigen Presenting Cells (APC). Immunology for 1st Year Medical Students. Dalhousie University (2004). Архивировано из первоисточника 12 января 2008. Проверено 12 ноября 2008.
- ↑ Delves et al. 2006, p. 161
- ↑ Sompayrac 2008, p. 8
- ↑ Delves et al. 2006, pp. 237–242
- ↑ Lange C, Dürr M, Doster H, Melms A, Bischof F (2007). «Dendritic cell-regulatory T-cell interactions control self-directed immunity». Immunol. Cell Biol. 85 (8): 575–81. DOI:10.1038/sj.icb.7100088. PMID 17592494. Проверено March 29, 2009.
- ↑ 1 2 Steinman, Ralph M. Dendritic Cells and Immune Tolerance. The Rockefeller University (2004). Архивировано из первоисточника 10 февраля 2012. Проверено 15 февраля 2009.
- ↑ Romagnani, S (2006). «Immunological tolerance and autoimmunity.». Internal and emergency medicine. 1 (3): 187–96. DOI:10.1007/BF02934736. PMID 17120464.
- ↑ Sompayrac 2008, pp. 16–17
- ↑ Sompayrac 2008, pp. 18–19
- ↑ Delves et al. 2006, p. 6
- ↑ Zen K, Parkos CA (October 2003). «Leukocyte-epithelial interactions». Curr. Opin. Cell Biol. 15 (5): 557–64. DOI:10.1016/S0955-0674(03)00103-0. PMID 14519390. Проверено March 29, 2009.
- ↑ Sompayrac 2008, p. 79
- ↑ Hoffbrand, Pettit & Moss 2005, p. 117
- ↑ Delves et al. 2006, pp. 1–6
- ↑ Sompayrac 2008, p. 45
- ↑ Takahashi K, Naito M, Takeya M (July 1996). «Development and heterogeneity of macrophages and their related cells through their differentiation pathways». Pathol. Int. 46 (7): 473–85. DOI:10.1111/j.1440-1827.1996.tb03641.x. PMID 8870002.
- ↑ Krombach F, Münzing S, Allmeling AM, Gerlach JT, Behr J, Dörger M (September 1997). «Cell size of alveolar macrophages: an interspecies comparison». Environ. Health Perspect. 105 Suppl 5: 1261–63. DOI:10.2307/3433544. PMID 9400735.
- ↑ 1 2 3 4 5 Bowers, William Immunology -Chapter Thirteen: Immunoregulation. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Архивировано из первоисточника 23 августа 2011. Проверено 14 ноября 2008.
- ↑ Ernst & Stendahl 2006, p. 8
- ↑ Delves et al. 2006, p. 156
- ↑ Delves et al. 2006, p. 187
- ↑ Stvrtinová Viera Neutrophils, central cells in acute inflammation // Inflammation and Fever from Pathophysiology: Principles of Disease. — Computing Centre, Slovak Academy of Sciences: Academic Electronic Press, 1995. — ISBN 80-967366-1-2
- ↑ Delves et al. 2006, p. 4
- ↑ 1 2 Sompayrac 2008, p. 18
- ↑ Linderkamp O, Ruef P, Brenner B, Gulbins E, Lang F (December 1998). «Passive deformability of mature, immature, and active neutrophils in healthy and septicemic neonates». Pediatr. Res. 44 (6): 946–50. DOI:10.1203/00006450-199812000-00021. PMID 9853933. Проверено April 6, 2009.
- ↑ Paoletti, Notario & Ricevuti 1997, p. 62
- ↑ Soehnlein O, Kenne E, Rotzius P, Eriksson EE, Lindbom L (January 2008). «Neutrophil secretion products regulate anti-bacterial activity in monocytes and macrophages». Clin. Exp. Immunol. 151 (1): 139–45. DOI:10.1111/j.1365-2249.2007.03532.x. PMID 17991288. Проверено March 29, 2009.
- ↑ Soehnlein O, Kai-Larsen Y, Frithiof R, et al (October 2008). «Neutrophil primary granule proteins HBP and HNP1-3 boost bacterial phagocytosis by human and murine macrophages». J. Clin. Invest. 118 (10): 3491–502. DOI:10.1172/JCI35740. PMID 18787642. Проверено March 29, 2009.
- ↑ Steinman RM, Cohn ZA (1973). «Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution». J. Exp. Med. 137 (5): 1142–62. DOI:10.1084/jem.137.5.1142. PMID 4573839.
- ↑ Steinman, Ralph Dendritic Cells. The Rockefeller University. Архивировано из первоисточника 10 февраля 2012. Проверено 14 ноября 2008.
- ↑ Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S (2002). «Antigen presentation and T cell stimulation by dendritic cells». Annu. Rev. Immunol. 20: 621–67. DOI:10.1146/annurev.immunol.20.100301.064828. PMID 11861614. Проверено March 29, 2009.
- ↑ Hoffbrand, Pettit & Moss 2005, p. 134
- ↑ Sallusto F, Lanzavecchia A (2002). «The instructive role of dendritic cells on T-cell responses». Arthritis Res. 4 Suppl 3: S127–32. DOI:10.1186/ar567. PMID 12110131.
- ↑ Sompayrac 2008, pp. 42–46
- ↑ Steinman, Ralph Dendritic Cells. The Rockefeller University. Архивировано из первоисточника 10 февраля 2012. Проверено 16 ноября 2008.
- ↑ Stelekati E, Orinska Z, Bulfone-Paus S (2007). «Mast cells in allergy: innate instructors of adaptive responses». Immunobiology 212 (6): 505–19. DOI:10.1016/j.imbio.2007.03.012. PMID 17544835. Проверено March 29, 2009.
- ↑ 1 2 Malaviya R, Abraham SN (February 2001). «Mast cell modulation of immune responses to bacteria». Immunol. Rev. 179: 16–24. DOI:10.1034/j.1600-065X.2001.790102.x. PMID 11292019. Проверено March 29, 2009.
- ↑ Connell I, Agace W, Klemm P, Schembri M, Mărild S, Svanborg C (September 1996). «Type 1 fimbrial expression enhances Escherichia coli virulence for the urinary tract». Proc. Natl. Acad. Sci. U.S.A. 93 (18): 9827–32. DOI:10.1073/pnas.93.18.9827. PMID 8790416.
- ↑ Malaviya R, Twesten NJ, Ross EA, Abraham SN, Pfeifer JD (February 1996). «Mast cells process bacterial Ags through a phagocytic route for class I MHC presentation to T cells». J. Immunol. 156 (4): 1490–96. PMID 8568252. Проверено March 29, 2009.
- ↑ Taylor ML, Metcalfe DD (2001). «Mast cells in allergy and host defense». Allergy Asthma Proc 22 (3): 115–19. DOI:10.2500/108854101778148764. PMID 11424870. Проверено March 29, 2009.
- ↑ 1 2 Paoletti, Notario & Ricevuti 1997, p. 427
- ↑ Birge RB, Ucker DS (July 2008). «Innate apoptotic immunity: the calming touch of death». Cell Death Differ. 15 (7): 1096–1102. DOI:10.1038/cdd.2008.58. PMID 18451871.
- ↑ Couzinet S, Cejas E, Schittny J, Deplazes P, Weber R, Zimmerli S (December 2000). «Phagocytic uptake of Encephalitozoon cuniculi by nonprofessional phagocytes». Infect. Immun. 68 (12): 6939–45. DOI:10.1128/IAI.68.12.6939-6945.2000. PMID 11083817.
- ↑ Segal G, Lee W, Arora PD, McKee M, Downey G, McCulloch CA. Involvement of actin filaments and integrins in the binding step in collagen phagocytosis by human fibroblasts. J Cell Sci. 2001 Jan;114(Pt 1):119-129. PubMed PMID: 11112696
- ↑ Rabinovitch M (March 1995). «Professional and non-professional phagocytes: an introduction». Trends Cell Biol. 5 (3): 85–87. DOI:10.1016/S0962-8924(00)88955-2. PMID 14732160.
- ↑ 1 2 3 4 5 Todar, Kenneth Mechanisms of Bacterial Pathogenicity: Bacterial Defense Against Phagocytes. 2008. Архивировано из первоисточника 10 февраля 2012. Проверено 10 декабря 2008.
- ↑ Alexander J, Satoskar AR, Russell DG (September 1999). «Leishmania species: models of intracellular parasitism». J. Cell. Sci. 112 Pt 18: 2993–3002. PMID 10462516.
- ↑ Celli J, Finlay BB (May 2002). «Bacterial avoidance of phagocytosis». Trends Microbiol. 10 (5): 232–37. DOI:10.1016/S0966-842X(02)02343-0. PMID 11973157.
- ↑ Valenick LV, Hsia HC, Schwarzbauer JE (September 2005). «Fibronectin fragmentation promotes alpha4beta1 integrin-mediated contraction of a fibrin-fibronectin provisional matrix». Experimental cell research 309 (1): 48–55. DOI:10.1016/j.yexcr.2005.05.024. PMID 15992798.
- ↑ Burns SM, Hull SI (August 1999). «Loss of resistance to ingestion and phagocytic killing by O(-) and K(-) mutants of a uropathogenic Escherichia coli O75:K5 strain». Infect. Immun. 67 (8): 3757–62. PMID 10417134. Проверено March 29, 2009.
- ↑ Vuong C, Kocianova S, Voyich JM, et al (December 2004). «A crucial role for exopolysaccharide modification in bacterial biofilm formation, immune evasion, and virulence». J. Biol. Chem. 279 (52): 54881–86. DOI:10.1074/jbc.M411374200. PMID 15501828. Проверено March 29, 2009.
- ↑ Melin M, Jarva H, Siira L, Meri S, Käyhty H, Väkeväinen M (February 2009). «Streptococcus pneumoniae capsular serotype 19F is more resistant to C3 deposition and less sensitive to opsonophagocytosis than serotype 6B». Infect. Immun. 77 (2): 676–84. DOI:10.1128/IAI.01186-08. PMID 19047408. Проверено March 29, 2009.
- ↑ 1 2 Foster TJ (December 2005). «Immune evasion by staphylococci». Nat. Rev. Microbiol. 3 (12): 948–58. DOI:10.1038/nrmicro1289. PMID 16322743.
- ↑ Sansonetti P (December 2001). «Phagocytosis of bacterial pathogens: implications in the host response». Semin. Immunol. 13 (6): 381–90. DOI:10.1006/smim.2001.0335. PMID 11708894.
- ↑ Dersch P, Isberg RR (March 1999). «A region of the Yersinia pseudotuberculosis invasin protein enhances integrin-mediated uptake into mammalian cells and promotes self-association». EMBO J. 18 (5): 1199–1213. DOI:10.1093/emboj/18.5.1199. PMID 10064587.
- ↑ Antoine JC, Prina E, Lang T, Courret N (October 1998). «The biogenesis and properties of the parasitophorous vacuoles that harbour Leishmania in murine macrophages». Trends Microbiol. 6 (10): 392–401. DOI:10.1016/S0966-842X(98)01324-9. PMID 9807783.
- ↑ Masek Katherine S. Eurekah Bioscience Collection: Evasion of Phagosome Lysosome Fusion and Establishment of a Replicative Organelle by the Intracellular Pathogen Legionella pneumophila. — Landes Bioscience.
- ↑ Das D, Saha SS, Bishayi B (July 2008). «Intracellular survival of Staphylococcus aureus: correlating production of catalase and superoxide dismutase with levels of inflammatory cytokines». Inflamm. Res. 57 (7): 340–49. DOI:10.1007/s00011-007-7206-z. PMID 18607538. Проверено March 29, 2009.
- ↑ Hara H, Kawamura I, Nomura T, Tominaga T, Tsuchiya K, Mitsuyama M (August 2007). «Cytolysin-dependent escape of the bacterium from the phagosome is required but not sufficient for induction of the Th1 immune response against Listeria monocytogenes infection: distinct role of Listeriolysin O determined by cytolysin gene replacement». Infect. Immun. 75 (8): 3791–3801. DOI:10.1128/IAI.01779-06. PMID 17517863.
- ↑ Datta V, Myskowski SM, Kwinn LA, Chiem DN, Varki N, Kansal RG, Kotb M, Nizet V (May 2005). «Mutational analysis of the group A streptococcal operon encoding streptolysin S and its virulence role in invasive infection». Mol. Microbiol. 56 (3): 681–95. DOI:10.1111/j.1365-2958.2005.04583.x. PMID 15819624.
- ↑ Iwatsuki K, Yamasaki O, Morizane S, Oono T (June 2006). «Staphylococcal cutaneous infections: invasion, evasion and aggression». J. Dermatol. Sci. 42 (3): 203–14. DOI:10.1016/j.jdermsci.2006.03.011. PMID 16679003.
- ↑ Denkers EY, Butcher BA (January 2005). «Sabotage and exploitation in macrophages parasitized by intracellular protozoans». Trends Parasitol. 21 (1): 35–41. DOI:10.1016/j.pt.2004.10.004. PMID 15639739. Проверено March 29, 2009.
- ↑ Gregory DJ, Olivier M (2005). «Subversion of host cell signalling by the protozoan parasite Leishmania». Parasitology 130 Suppl: S27–35. DOI:10.1017/S0031182005008139. PMID 16281989. Проверено March 29, 2009.
- ↑ Paoletti pp. 426-30
- ↑ Heinzelmann M, Mercer-Jones MA, Passmore JC (August 1999). «Neutrophils and renal failure». Am. J. Kidney Dis. 34 (2): 384–99. DOI:10.1016/S0272-6386(99)70375-6. PMID 10430993.
- ↑ Lee WL, Downey GP (February 2001). «Neutrophil activation and acute lung injury». Curr Opin Crit Care 7 (1): 1–7. DOI:10.1097/00075198-200102000-00001. PMID 11373504.
- ↑ 1 2 Moraes TJ, Zurawska JH, Downey GP (January 2006). «Neutrophil granule contents in the pathogenesis of lung injury». Curr. Opin. Hematol. 13 (1): 21–27. DOI:10.1097/01.moh.0000190113.31027.d5. PMID 16319683.
- ↑ Abraham E (April 2003). «Neutrophils and acute lung injury». Crit. Care Med. 31 (4 Suppl): S195–99. DOI:10.1097/01.CCM.0000057843.47705.E8. PMID 12682440.
- ↑ Ricevuti G (December 1997). «Host tissue damage by phagocytes». Ann. N. Y. Acad. Sci. 832: 426–48. DOI:10.1111/j.1749-6632.1997.tb46269.x. PMID 9704069.
- ↑ Charley B, Riffault S, Van Reeth K (October 2006). «Porcine innate and adaptative immune responses to influenza and coronavirus infections». Ann. N. Y. Acad. Sci. 1081: 130–36. DOI:10.1196/annals.1373.014. PMID 17135502. Проверено March 31, 2009.
- ↑ Sompayrac 2008, p. 1
- ↑ 1 2 Cosson P, Soldati T (June 2008). «Eat, kill or die: when amoeba meets bacteria». Curr. Opin. Microbiol. 11 (3): 271–76. DOI:10.1016/j.mib.2008.05.005. PMID 18550419. Проверено April 5, 2009.
- ↑ Bozzaro S, Bucci C, Steinert M (2008). «Phagocytosis and host-pathogen interactions in Dictyostelium with a look at macrophages». Int Rev Cell Mol Biol 271: 253–300. DOI:10.1016/S1937-6448(08)01206-9. PMID 19081545. Проверено April 5, 2009.
- ↑ Chen G, Zhuchenko O, Kuspa A (August 2007). «Immune-like phagocyte activity in the social amoeba». Science (journal) 317 (5838): 678–81. DOI:10.1126/science.1143991. PMID 17673666.
- ↑ Delves et al. 2006, pp. 251–252
- ↑ Hanington PC, Tam J, Katzenback BA, Hitchen SJ, Barreda DR, Belosevic M (April 2009). «Development of macrophages of cyprinid fish». Dev. Comp. Immunol. 33 (4): 411–29. DOI:10.1016/j.dci.2008.11.004. PMID 19063916. Проверено April 5, 2009.
Литература
- Delves P. J. Roitt's Essential Immunology. — 11th. — Malden, MA: Blackwell Publishing, 2006. — ISBN 1405136030
- Phagocytosis of Bacteria and Bacterial Pathogenicity. — New York: Cambridge University Press, 2006. — ISBN 0521845696 Website
- Hoffbrand A. V. Essential Haematology. — 4th. — London: Blackwell Science, 2005. — ISBN 0632051531
- Janeway C. A. Immunobiology. — 5th. — New York: Garland Science, 2001. — ISBN 081533642X
- Phagocytes: Biology, Physiology, Pathology, and Pharmacotherapeutics. — New York: The New York Academy of Sciences, 1997. — ISBN 1573311022
- Phagocyte Function — A guide for research and clinical evaluation. — New York: Wiley–Liss, 1998. — ISBN 0471123641
- Sompayrac L. How the Immune System Works. — 3rd. — Malden, MA: Blackwell Publishing, 2008. — ISBN 9781405162210
При написании этой статьи использовался материал из Энциклопедического словаря Брокгауза и Ефрона (1890—1907).Категории:- Кровь
- Физиология
- Клетки
Wikimedia Foundation. 2010.